ऊष्मा एवं ताप
ऊष्मा एक प्रकार की ऊर्जा है. ऊष्मा के कारण ही हमें गर्म और ठंडा महसूस होता है. जब ऊष्मा हमारे शरीर में प्रवेश करती है तो हमे गर्म महसूस होता है और जब ऊष्मा हमारे शरीर से बाहर जाती है तो हमें ठंडा महसूस होता है. यदि हम अपने एक हाथ को कुछ देर तक गर्म पानी में और दूसरे हाथ को ठंडे पानी में डुबाकर रखें और इसके बाद दोनो हाथों को कमरे के तापमान वाले पानी में डालें, तो जो हाथ पहले गर्म पानी में था, उसे यह पानी ठंडा महसूस होगा, क्योंकि वह हाथ गर्म हो चुका है और उससे से ऊष्मा बाहर जा रही है, और जो हाथ पहले ठंडे पानी में रखा था उसे यह पानी गर्म महसूस होगा क्योंकि वह हाथ ठंडा हो चुका है और उसमें ऊष्मा प्रवेश कर रही है.
ऊष्मा का प्रभाव यह है कि उसके कारण कोई वस्तु गर्म या ठंडी महसूस होती है. गर्म या ठंडा महसूस होने को ही तापमान कहते हैं. तापमान को मापने के लिये थर्मामीटर का प्रयोग किया जाता है. यह आवश्यक नहीं है कि जिस वस्तु में अधिक ऊष्मा हो उसका तापमान ऐसी वस्तु से कम होगा जिसमें कम ऊष्मा है. दरअसल हम ऊष्मा की तुलना पानी जैसे किसी द्रव की मात्रा से कर सकते हैं, और तापमान की तुलना द्रव के तल से कर सकते हैं. यदि हम किसी छोटे बर्तन और बड़े बर्तन में एक समान मात्रा में पानी डालें तो बड़े बर्तन में पानी का तल नीचा होगा और छोटे बर्तन में ऊंचा. इसी प्रकार किसी बड़े आकार की वस्तु और छोटे आकार की वस्तु को एक बराबर समय तक गर्म करने पर बड़े आकार की वस्तु में ऊष्मा तो छोटे आकार की वस्तु से अधिक होगी परंतु छोटे आकार की वस्तु का तापमान अधिक होगा अत: वह छोटे आकार की वस्तु अधिक गर्म प्रतीत होगी. जैसे पानी ऊंचे तल से नीचे तल की ओर बहता है, वैसे ही ऊष्मा भी अधिक तापमान से कम तापमान की ओर बहती है.
ऊष्मा एवं अन्य प्रकार की ऊर्जा – ऊष्मा एवं अन्य प्रकार की ऊर्जा एक दूसरे में परिवर्तित की जा सकती हैं. इनके उदाहरण नीचे दिये गये हैं –
- गतिज ऊर्जा से ऊष्मा – हाथ रगड़ना -

- रायासनिक ऊर्जा से ऊष्मा – भोजन के पाचन से ऊष्मा बनना –

- बिजली से ऊष्मा - बीजली का हीटर –

- ऊष्मा से प्रकाश – जलती मोमबत्ती -

- ऊष्मा से गतिज ऊर्जा – स्टीम इंजन -
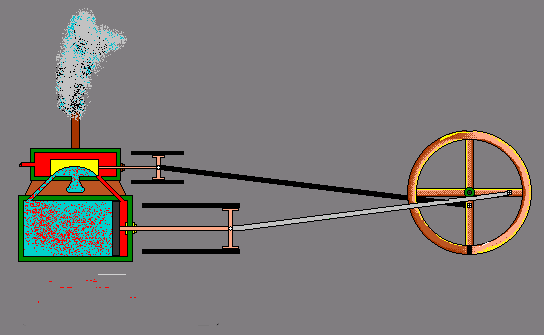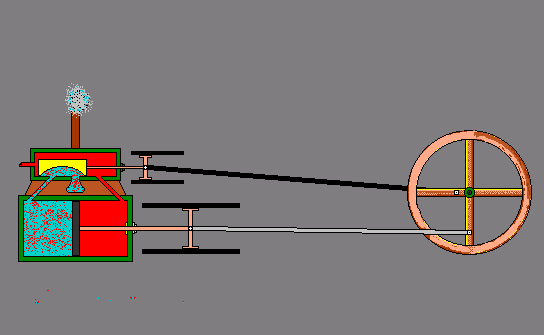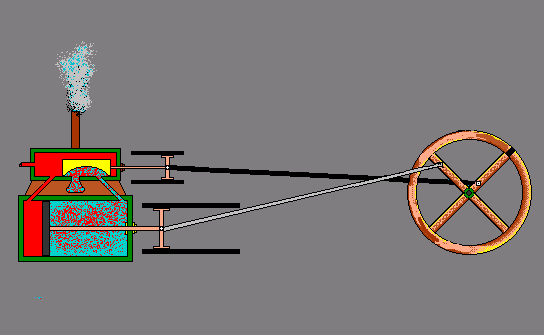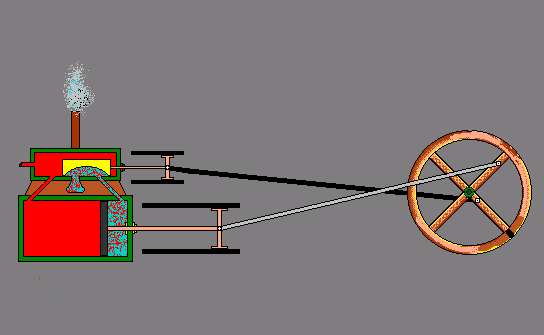
ऊष्मा के प्रभाव –
- तापमान में वृध्दि – इसे तापमापी से देखा जा सकता है।
- प्रसार –
- द्रव में प्रसार – गर्म पानी में रखने पर तापमापी में पारा चढ़ता है -

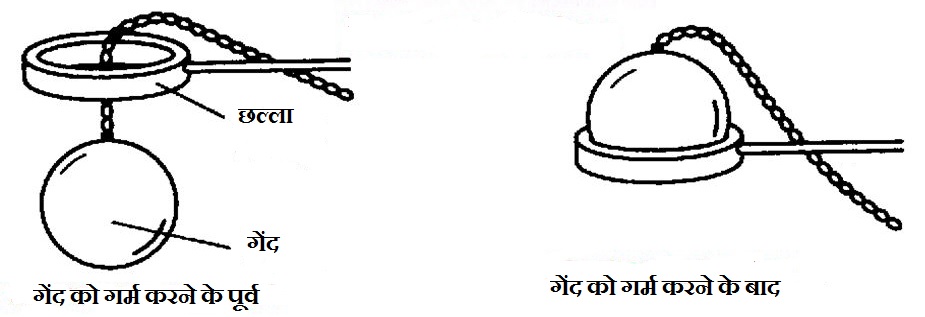
- ठोस में प्रसार – एक गेंद जो साधारण रूप से एक छल्ले से निकल जाती है, उसे गर्म करने पर वह छल्ले से नहीं निकल पाती और ठंडा करने पर पुन: निकल जाती है –
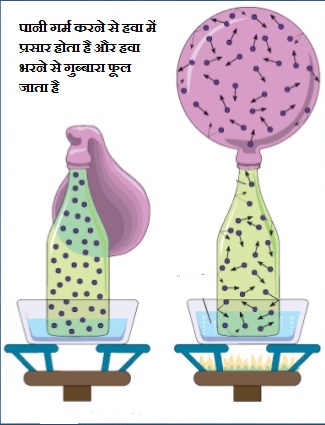
- गैस में प्रसार – एक बोतल के मुह पर एक गुब्बारा बांध दें. अब बोतल को पानी में रखकर पानी को गर्म करें. गर्म पानी से ऊष्मा बोतल में बंद हवा में जाती है, जिससे हवा में प्रसार होता है और यह हवा गुब्बारे में जाकर गुब्बारे को फुला देती है.
- अवस्था परिवर्तन – हम यदि बर्फ के कुछ टुकड़ों को एक बर्तन में रखकर गर्म करें तो कुछ समय में बर्फ पानी में बदल जाता है और अधिक गर्म करने पर वाष्प में बदल जाता है. प्रत्येक पदार्थ एक निश्चित तापमान पर ठोस से द्रव में बदलता है. इसे उस पदार्थ का हिमांक अथवा गलनांक कहते हैं. इसी प्रकार प्रत्येक पदार्थ एक निश्चित तापमान पर द्रव से गैस में बदलता है. इसे उसका क्वथनांक या संघनन बिन्दु कहते हैं. जब कोई पदार्थ गलना प्रारंभ करता है तो उसे ऊष्मा देने पर भी उसका तापमान तब तक नहीं बढ़ता जब तक वह पूरा न गल जाए. इसी प्रकार जब कोई पदार्थ द्रव से वाष्प में परिवर्तित होता है तो उसका तापमान तब तक स्थिर रहता है जब तक वह पूरा वाष्प में न बदल जाए. ऐसा इसलिये होता है कि इस समय ऊष्मा तापमान को न बढाकर पदार्थ के अणुओं की गतिज ऊर्जा को बढ़ाने का काम करती है. इस ऊष्मा को गुप्त ऊष्मा कहा जाता है.
- रासायनिक परिवर्तन –
- ऊष्मा ग्रहण करने वाले (एण्डोथर्मिक) रासायनिक परिवर्तन – अधिकतर रासायनिक परिवर्तन तभी होते हैं जब क्रिया करने वाले पदार्थों को ऊष्मा दी जाए. अत: इन रासायनिक परिवर्तनो में ऊष्मा अवशोषित हुई. इन्हें एण्डोथर्मिक कहते हैं. उदाहरण के लिये यदि लोहे की छीलन को गंधक के साथ मिलाया जाये तो तब तक कोई क्रिया नहीं होती जब तक इस मिश्रण को गर्म न किया जाये. गर्म करने पर रासायनिक क्रिया से लोहे का सल्फाइड बन जाता है. यह एण्डोथर्मिक क्रिया है.
- ऊष्मा छोड़ने वाले (एक्ज़ोथर्मिक) रायासनिक परिवर्तन – कुछ रासायनिक परविर्तनो में ऊष्मा बाहर निकलती है. उदाहरण के लिये यदि पानी में चूना मिलाया जाये तो ऊष्मा निकलने के कारण पानी उबलने लगता है.
- जैविक परिवर्तन – यद्यपि जीवों को जीवित रहने के लिये ऊष्मा की आवश्यकता है तथापि बहुत अधिक तापमान पर वे जीवित नहीं रह सकते. इसीलिये पीने के पानी को बैक्टीरिया आदि से शुध्द करने के लिये उसे उबाला जाता है.
ऊष्मा का मापन – ऊष्मा को तापमान में वृध्दि के व्दारा मापा जा सकता है. एक किलोग्राम जल का तापमान एक डिग्री सेंटीग्रेड बढ़ाने के लिये आवश्यक ऊष्मा की मात्रा को एक केलोरी कहा जाता है. 1 केलोरी में 4.186 जूल होते हैं.
ऊष्मा धारिता – किसी बर्तन में जितनी मात्रा में जल समा सकता है वह जल उस बर्तन की जल धारण करने की क्षमता अथवा जल धारिता है. इसी प्रकार किसी पदार्थ में जितनी मात्रा में ऊष्मा समा सकती है वह उसकी ऊष्मा धारिता है. किसी पदार्थ की ऊष्मा धारिता जितनी अधिक होगी ऊष्मा देने पर उसका तापमान उतना ही कम बढ़ेगा. तेल की ऊष्मा धारिता जल की तुलना में कम है इसलिये तेल जल की तुलना में कम ऊष्मा देने पर भी अधिक गर्म हो जाता है. किसी पदार्थ की 1 किलोग्राम मात्रा का तापमान 1 डिग्री सेंटीग्रेड बढ़ाने के लिये आवश्यक ऊष्मा की मात्रा को उस पदार्थ की विशिष्ट ऊष्मा धारिता कहते है.